СОР № 1 Химия 9 класс Обратимые реакции
НазадОбратимые реакции
Задание:
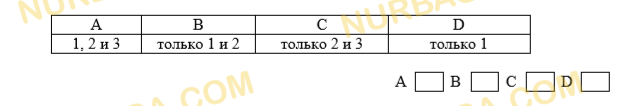
1. Определите, каковы характеристики динамического равновесия.
1) Имеются равные количества реагентов и продуктов.
2) Концентрации реагентов и продуктов остаются постоянными.
3) Скорость прямой реакции такая же, как скорость обратной реакции.
Какое из утверждений верно?
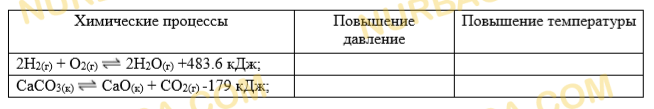
2. Заполните таблицу, указав смещение химического равновесия при влиянии внешних факторов на следущие процессы:
3. Укажите, какие изменения внешних факторов позволят увеличить выход продукта следующей реакции
![]()
Решение:
1.С
2. 2H2 + O2 = 2H2O + 483.6 кДж.
Повышение давления — равновесие смещается вправо (исходных — 3 моль газов, а продуктов — 2 моль газов)
Повышение температуры — влево (т.к. в после реакции образуется тепло)
CaCO3 = CaO + CO2 — 179 кДж
Повышение давления — равновесие смещается влево (справа образуется газ)
Повышение температуры — вправо (т.к. в при реакции поглощается тепло)
3. Равновесный выход прямой реакции можно увеличить, понижая температуру и повышая давление. При этом от понижения температуры «страдает» практический выход из-за уменьшения скорости. Выход реакции увеличивает также повышение концентрации СО и снижение концентрации СО2 в системе.
Для практики имеет большое значение ОБРАТНАЯ реакция — газификация угля. А приведенная реакция может быть одной из стадий в процессе получения технического углерода или сажи.