СОР № 1 Химия 10ОГН класс Строение атома/ Квантовые числа. Принцип Паули, правило Хунда, правило Клечковского
НазадСтроение атома/ Квантовые числа. Принцип Паули, правило Хунда, правило Клечковского
Задание:
Ответьте на вопросы:
1. Что такое электронная оболочка?
2. Как двигаются электроны?
3. Что такое электронный слой или энергетический уровень?
4. Как определить число электронных уровней у атома элемента?
5. Сколько электронов на внешнем уровне?
6. Как распределяются электроны по электронным уровням?
7. Что такое орбиталь? Виды орбиталей.
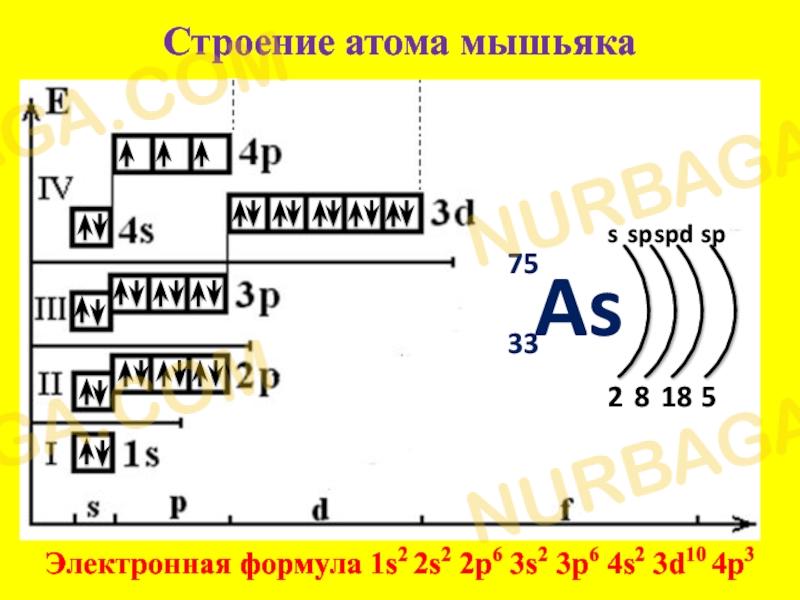
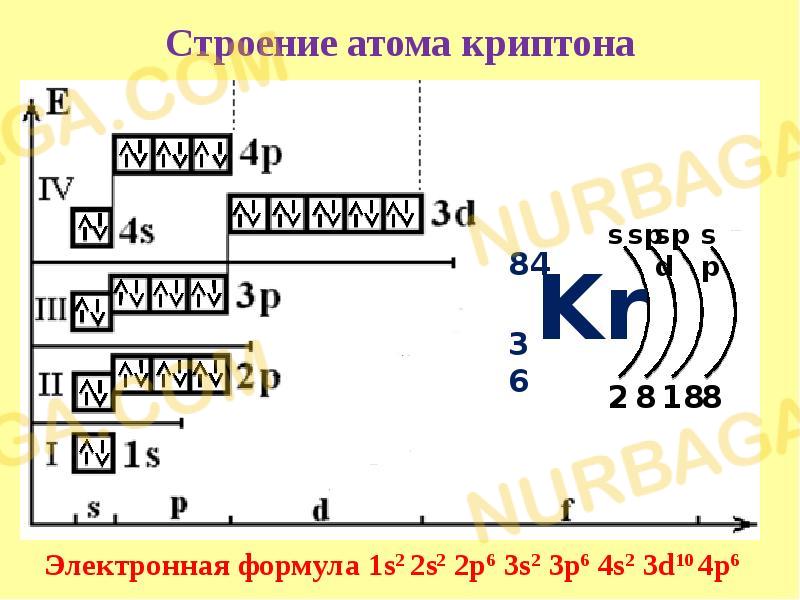
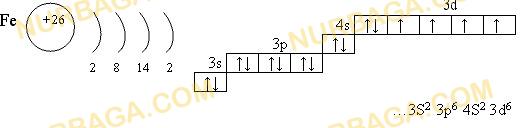
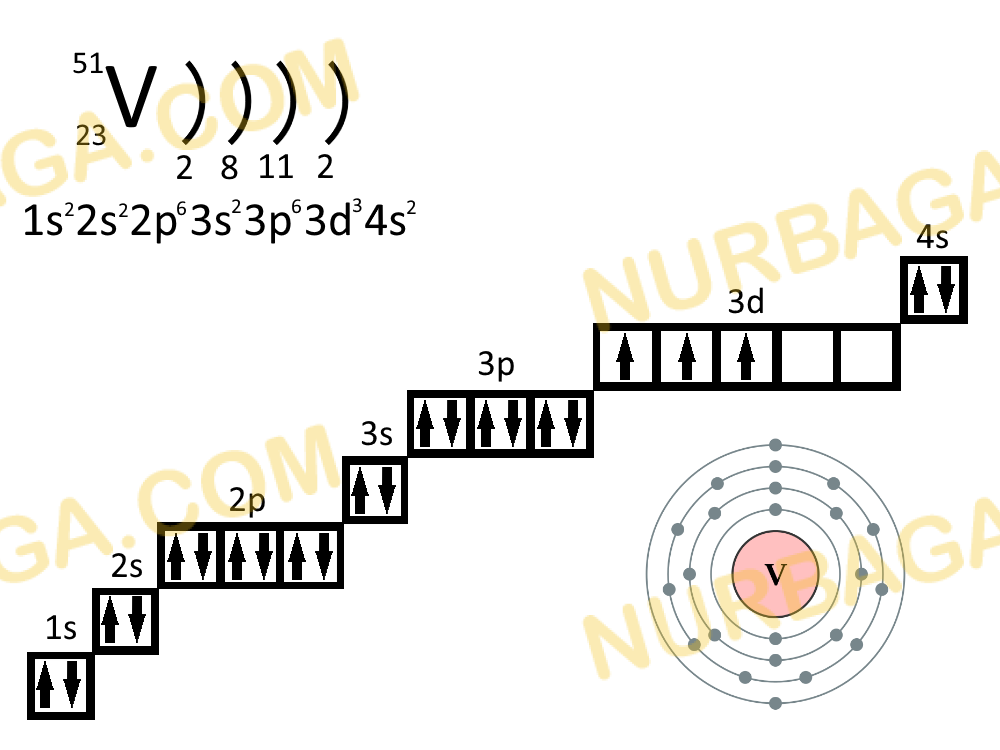
8. Составить электронно-графические формулы для ванадия, железа, мышьяка,
криптона
Решение:
1. Электронная оболочка — область пространства наиболее вероятного нахождения электронов, имеющих одинаковое значение главного квантового числа n и, как следствие, располагающихся на близких энергетических уровнях.
2.Электроны двигаются против направления электрического поля. Ток течет в направлении движения положительных зарядов.
3. Электронный слой — это совокупность электронов с близкими значениями энергии. Число электронов на том или ином слое различно и в основном определяется их энергией.
4. Число энергетических уровней (электронных слоев) в атоме равно номеру периода в системе Д. И. Менделеева, к которому принадлежит химический элемент: у атомов элементов первого периода один энергетический уровень; второго периода — два; седьмого периода — семь.
5. Уровень, максимально удалённый от ядра атома, называется внешним. Электроны, находящиеся на внешнем энергетическом уровне, называются внешними (валентными) электронами. Число электронов на внешнем энергетическом уровне совпадает с номером группы, в которой находится химический элемент. Внешний уровень считается завершённым, если содержит 8 электронов.
6. Для удобства электроны можно распределить по энергетическим уровням, воспользовавшись формулой N=2n2 и с учётом того, что: 1. у элементов главных подгрупп (s-; p-элементы) число электронов на внешнем уровне равно номеру группы.
7. Орбиталь — область наиболее вероятного местонахождения электрона в атоме (атомная орбиталь) или в молекуле (молекулярная орбиталь). К настоящему моменту описано пять типов орбиталей: s, p, d, f и g. Названия первых трех сложились исторически, далее был выбран алфавитный принцип.
8.