СОР № 1 Химия 10ОГН класс Периодический закон и периодическая система химических элементов/ Периодичность изменения свойств элементов в главных подгруппах и периодах
НазадПериодический закон и периодическая система химических элементов/ Периодичность изменения свойств элементов в главных подгруппах и периодах
Задание:
1. а) Радиус атома — общий термин. Измерения производятся из металлических радиусов
металлов и ковалентных радиусов для молекул. Нарисуйте диаграмму, чтобы
показать, как вы могли бы рассчитать атомный радиус двух ковалентно связанных
атомов.
b) Укажите и объясните общую тенденцию атомного радиуса по 3 периоду (за
исключением Аргона).
c) Почему Аргон не следует этой тенденции?
d) Определите влияние атомного радиуса на первую энергию ионизации элемента.
2. Значения первых энергий ионизации неона, натрия и магния составляют 2080, 494 и 736
кДж*моль-1
соответственно.
a) Объясните значение термина «первая ионизация атома».
b) Напишите уравнение для измерения второй энергии ионизации магния.
c) Объясните, почему значение первой энергии ионизации магния выше, чем значение
первой энергии натрия.
d) Объясните, почему значение первой энергии ионизации неона выше, чем значение
первой энергии натрия.
3. а) Сродство к электрону у хлора (3,70 эВ) намного больше, чем у фосфора (0,77 эВ).
Объясните причину этого явления.
b) Почему сродство к электрону, постепенно возрастающее при переходе от N к О и F,
резко уменьшается у Ne?
4. В таблице ниже приведены значения электроотрицательности для элементов периода 3,
за исключением хлора.
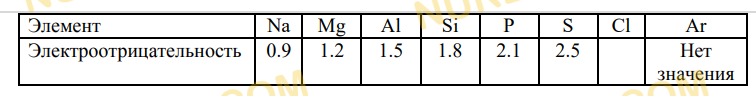
а) Дайте определение термину электроотрицательность.
b) Объясните, почему в 3 периоде электроотрицательность возрастает.
с) Предположите значение электроотрицательности хлора и лития.
5. а) Что такое степень окисления?
b) Как изменяется степень окисления в периодах и группах?
6. Определите степени окисления атомов в неорганических соединениях:
а) Na2S, Na3N, NaBr. MgCl2, MgS, Mg3N2. Al2S3, Al2O3.
b) N2O, NH3, NO2, N2O3, N2O5. SO3, SO2, H2S. Fe2O3, FeO
Решение:
1. а) 
b) Общая тенденция атомного радиуса такова: он уменьшается слева направо в течение периода из-за увеличения числа электронов в одной и той же оболочке наряду с равным увеличением положительного заряда в ядре.
c) Аргон—это благородный газ(инертный)потому что он располагается в 8 группе(завершающей)ему не нужны электроны для заполнения своих электронных оболочек,так как в 8 группе располагаются элементы с заполненными электронными оболочками.
d) Энергия ионизации атомов — отрыва от них валентных электронов — непосредственно определяется положением металла в периодической системе. Энергия, выделяющаяся при гидратации, зависит от электронной структуры нона, его заряда и радиуса.
2. Значения первых энергий ионизации неона, натрия и магния составляют 2080, 494 и 736
кДж*моль-1
соответственно.
a) Первая энергия ионизации — это количество энергии, которое требуется газообразному нейтральному атому для удаления своего внешнего электрона.Этот самый внешний электрон находится на самой внешней орбите атома.
b) Энергия ионизации-это энергия, необходимая для удаления одного из самых внешних (валентных) электронов из атома. Чем стабильнее электрон в атоме, тем труднее его удалить из атома и тем выше энергия ионизации. Валентные электроны в магнии более стабильны, чем в натрии, главным образом потому, что в ядре магния на один протон больше, чем в натрии. Таким образом, даже несмотря на то, что валентные электроны магния находятся на орбитали того же типа (3s), что и натрий, они больше притягиваются к более положительному ядру и, следовательно, их труднее удалить.
c) Энергия ионизации-это количество энергии, необходимое для отделения одного электрона от нейтрального атома. Некоторые элементы на самом деле имеют несколько энергий ионизации. Когда это так, мы называем их «первой энергией ионизации» или «Я», «второй энергией ионизации» или «Я 2», и так далее. Обратите внимание, что переменная энергии следует за I где i-орбиталь, с которой теряется электрон. Ионизация является эндотермической, что означает, что атом или молекула увеличивает свою внутреннюю энергию (берет энергию из внешнего источника). Уравнение для первой энергии ионизации показано ниже:
Na —> Na+ + e-
Уравнение для второй энергии ионизации имеет вид:
Na+ —> Na2+ + e-
Значения энергии ионизации, как правило, очень высоки и следуют тенденциям во всей периодической таблице. ИЭ увеличиваются снизу вверх и слева направо в периодической таблице.
d) 1-й ИЭ Na: 494 кДж моль-1
1-й ИЭ Ne: 2080 кДж моль-1
Данные показывают, что Ne имеет более высокий 1-й IE.
Затем перейдем к следующему вопросу: Почему?
Энергия ионизации-это энергия, необходимая для преодоления электростатических сил притяжения между положительно заряженным ядром и самым внешним (валентным) электроном.
Давайте сначала обратим наше внимание на ядро. Na имеет протонное число 11, в то время как Ne имеет протонное число 10. У Na на один протон больше, чем у Ne. Большее количество протонов в ядре приводит к более высокому ядерному заряду.
Давайте тогда посмотрим на другую сторону, вовлеченную в это, которая является электронами. 11 и 10 для Na и Ne соответственно. Поэтому естественно возникает вопрос. разве соотношение протонов и электронов не одно и то же? 1 протон на 1 электрон? Разве тогда они оба не должны испытывать одну и ту же электростатическую силу притяжения?
Здесь мы рассмотрим электроны, подлежащие удалению, более подробно и более конкретно, где они расположены. Электроны не плавают случайным образом. Мы узнаем, что они занимают оболочки, а на более поздних уровнях-орбитали.
Na имеет электронную конфигурацию: 1s2 2s2 2p6 3s1
Ne имеет электронную конфигурацию: 1s2 2s2 2p6
Электрон Na, подлежащий удалению, находится в 3s-подоболочке, в то время как электрон Ne, подлежащий удалению, находится в 2p-подоболочке.
Мы знаем, что главное квантовое число дает нам приблизительное представление о расстоянии электрона от ядра. Поскольку электрон Na, подлежащий удалению, находится в 3-й основной квантовой оболочке, он расположен дальше от ядра по сравнению с удаляемым электроном Ne.
Мы будем считать, что электрон и ядро (заполненное протонами) являются точечными зарядами. Электростатическая сила обратно пропорциональна квадрату расстояния между двумя точечными зарядами. Хотя ядерный заряд Na больше, расстояние между ядром и электроном играет большую роль (поскольку оно равно квадрату). Таким образом, электростатическая сила, испытываемая электроном в Na, намного меньше, чем в Ne, и, следовательно, Na имеет более низкий 1-й IE по сравнению с Ne.
Другой способ взглянуть на это-использовать идею экранирующего эффекта. Электроны внутренней оболочки, как следует из названия, относятся к электронам, которые находятся в электронных оболочках до валентного электрона.
Для Na электроны 1s, 2s и 2p являются электронами внутренней оболочки, в то время как для Ne электроны 1s являются электронами внутренней оболочки. Электроны внутренней оболочки обеспечивают так называемый экранирующий эффект.
Поскольку подобные заряды отталкиваются, электроны внутренней оболочки отталкивают валентные электроны дальше от ядра. Это означает, что валентный электрон Na испытывает больший эффект экранирования, поскольку существует большее количество электронов внутренней оболочки. Еще раз, это также означает, что валентный электрон Na находится дальше от ядра по сравнению с валентным электроном Ne. Как упоминалось выше, увеличенное расстояние между валентным электроном и ядром приводит к меньшей электростатической силе притяжения, которую необходимо преодолеть, и, следовательно, Na имеет более низкий 1-й IE по сравнению с Ne.
3. а) Сродство к электрону-это в основном то энергия атома изменяется из-за добавления нового электрона. Х + е− → х + Δ (тепло).
b) От азота к фтору радиус атома уменьшается, следовательно действует большая сила притягивающая электрон, при образовании связи, а у неона просто некуда принимать электроны, поэтому его способность их принимать практически полностью отсутсутствует. Что и доказывается его инертностью
У кадмия и у стронция отличается строение предпоследнего уровня, у кадмия он заполнен 4d, а у стронция он пустой
4. а) Электроотрицательность — это способность атома в молекуле смещать к себе общие электронные пары. Она является необходимым показателем для описания молекулярных систем, определения типа связей в молекуле, распределения ионного заряда между взаимодействующими элементами. К факторам, которые влияют на эту величину, относятся: валентное состояние атома, степень окисления, координационное число и другие.
b) Хлор и сера расположены в третьем периоде. Электроотрицательность по периоду возрастает слева направо. ЭО хлора больше ЭО серы, значит, электроны будут сдвинуты от серы к хлору. Заряд атома серы будет положительным, а хлора — отрицательным.
с) Электроотрицательность по Полингу 0,98, самая большая ущелочных металлов.В виде простого вещества литий — мягкий, пластичный, легкий, серебристый металл.
5. а) Окисление — химический процесс, сопровождающийся увеличением степени окисления атома окисляемого вещества посредством передачи электронов от атома восстановителя (донора электронов) к атому окислителя (акцептору электронов).
b) В периоде можно наблюдать рост показателя слева направо при повышении числа электронов на внешнем слое. В группе данная характеристика уменьшается по направлению вниз с увеличением количества электронных слоев и атомных радиусов. Максимальная электроотрицательность в каждом периоде характерна для наиболее маленьких атомов, которые имеют семь внешних электронов, то есть атомов галогенов.
6. а) Na2(+)S(-2); Na3(+)N(-3); Na(+)Br(-); Mg(+2)Cl2(-); Mg(+2)S(-2); Mg3(+2)N2(-3); Al2(+3)S3(-2); Al2(+3)O3(-2)
б) N2(+)O(-2); N(+3)H3(-); N(+4)O2(-2); N2(+3)O3(-2); N2(+5)O5(-2); S(+6)O3(-2); S(+4)O2(-2); H2(+)S(-2); Fe2(+3)O3(-2); Fe(+2)O(-2)