СОР № 1 Химия 9 класс Металлы и сплавы
НазадМеталлы и сплавы
Задание:
На рисунке показан аппарат для измерения объема водорода, выделенного при добавлении к порошкообразному металлу избытка разбавленной соляной кислоты. Объем газа измерен при комнатной температуре и нормальном атмосферном давлении.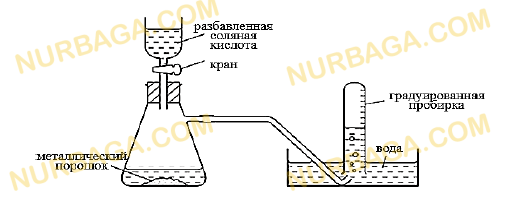
Эксперимент выполнен три раза, используя различные металлы одинаковой массы.
чистый магний
чистый цинк
смесь магния и цинка
Назовите металл, при реакции с которым выделяется больший объем водорода и металл, при реакции с которым выделяется наименьший объем водорода.
Решение:
Запишем уравнения реакций:
Mg+2HCl=MgCl2+H2
Zn+2HCl=ZnCl2+H2..
Исходя из уравнений, количество водорода, синтезируемое в результате первой и второй реакций равно и будет зависеть только от количества металлов (определяем по недостатку), тогда, запишем формулы для количеств Mg и Zn:
1. υ(Mg)=m(Mg)/M(Mg)=m(Mg)/24
2. υ(Zn)=m(Zn)/M(Zn)=m(Zn)/65
т.к. m(Zn)=m(Mg) по условию, пусть m(Zn)=m(Mg)=х, очевидно, что х/24>х/65, следует, что υ(H2)1>υ(H2)2,
тогда и, V(H2)1=υ(H2)1*Vm,
V(H2)2=υ(H2)2*Vm, Vm=const
следует, что: V(H2)1>V(H2)2